BreadCrumb
公益財団法人 日本呼吸器財団
COVID-19関連研究助成のご報告
IL‐6‐STAT3系を介したSARS‐CoV‐2受容体ACE2の発現調節機構の解明
研究者 広島大学病院 リウマチ膠原病科・研究員 茂久田 翔 先生
研究成果
新型コロナウイルス感染症(COVID-19)は、2019年より世界中で感染拡大を認め、2020年以降は本邦でも感染者の増加を認めている。COVID-19は致死率の高い疾患であるが、有効な新規治療法・ワクチンの開発が進んだ結果、本邦での致死率は低下した。しかしながら、これまでの創薬は病原体であるSARS-CoV-2ウイルス由来の分子を標的として行われたこともあり、短期間でウイルスの抗原変異が確認され、一部のワクチンなどで有効性の低下が認められている。もし、宿主(ヒト)の蛋白を対象にCOVID-19の治療薬を設計することができれば、抗原の変異と関係なく持続的な効果が期待できる可能性が高い。
SARS-CoV-2ウイルスは、ウイルス表面のスパイクタンパク(Sタンパク)が宿主受容体群であるアンギオテンシン変換酵素2(ACE2)及びニューロピリン(NRP)(NRP1とNRP2の2種類のタンパクが存在する)と結合することで細胞内への侵入を可能とする。申請者らは、重症COVID-19患者の体内でインターロイキン(IL)-6、IL-1β、腫瘍壊死因子(TNF)αなどの炎症性サイトカインが高濃度であることに着目した。IL-1β及びTNFαの刺激によってIL-6の産生が増強されることは以前から報告されていた。そこで、滑膜線維芽細胞を用いて網羅的に遺伝子発現解析(次世代シーケンシング解析)を行い、IL-1β刺激によってNRP1及びNRP2の発現が上昇していることを確認した(未発表・図1)。次に、数種類のサイトカイン別に刺激を行い、ACE2、NRP1、NRP2の発現変動を確認したところ、TNFαとIL-1βの共刺激よって3遺伝子すべての発現が亢進することが明らかとなった。さらに、リコンビナントSタンパクを培養上清中に添加し、細胞への結合能を評価した。その結果、TNFαおよびIL-1βによる共刺激を加えた細胞で、無刺激の場合と比較し、Sタンパクとの結合能が約3倍に増加していることが判明した(未発表・図2)。これらの結果は、炎症性サイトカイン、宿主受容体群、及び、SARS-CoV-2の間に一定の相互作用があることを示唆した。今後、この実験系を利用し、受容体の発現量低下を主な機序としたSタンパクと受容体間の結合を阻害する化合物等を同定し、ヒト宿主を標的とした新規治療法の開発を目指したい。
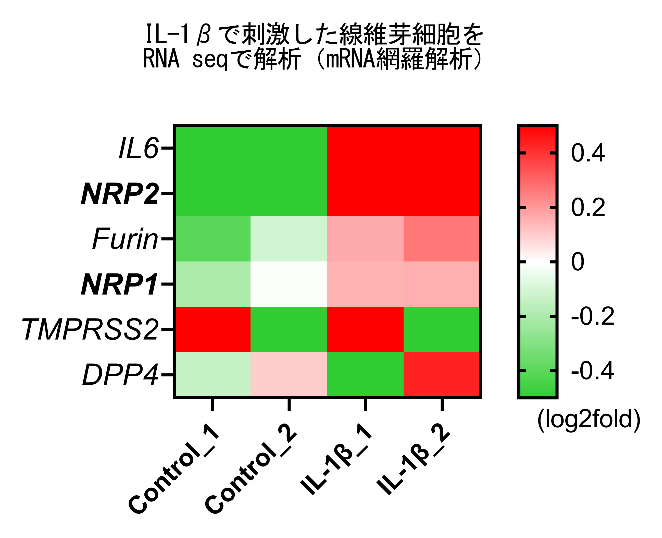
図1
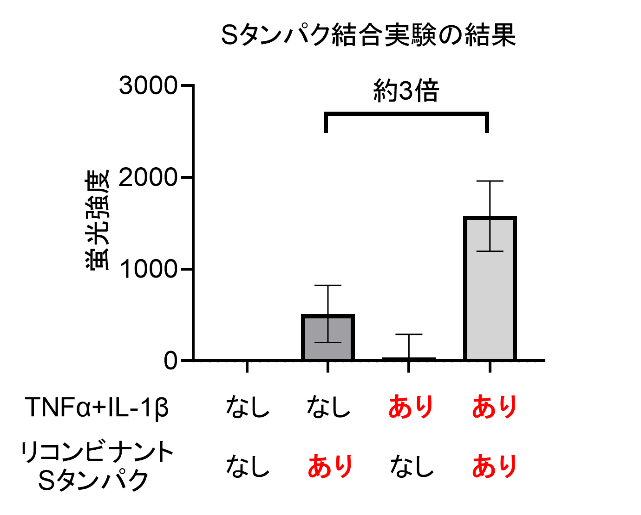
図2
第63回日本呼吸器学会学術講演会での報告
受賞コメント

2019年より世界中に拡散しているSARS-CoV-2による感染症であるCOVID-19は、現在でも欧米を中心に大規模な感染拡大を認めています。重症例(酸素吸入例や人工呼吸器使用例)において死亡率を低下しうる薬剤として、副腎皮質ステロイド剤や抗IL-6受容体抗体などが報告されています。一方で、軽症例に対しては有効な治療薬の報告がほとんどなく、早急な開発が期待されます。本研究では、SARS-CoV-2の宿主受容体ACE2の発現を抑制することのできる新規薬剤の開発を目指します。特に、ACE2の発現がIL-6やその下流にあるSTAT3によって誘導されることから、IL-6のシグナル伝達に関与する分子に着目し、研究を進めていきたいと考えています。